Úvod
Název projektu:
NMR krystalografie aktivních farmaceutických substancí pro průmyslové aplikace
Program:
NPV II – ZDRAVÝ A KVALITNÍ ŽIVOT
Kod projektu:
2B08021
Doba řešení projektu:
2008-2011
Řešitelská pracoviště:
ÚMCH AV ČR, VŠCHT Praha
Řešitel a spoluřešitel: Ing. Jiří Brus PhD a prof. RNDr. Bohumil Kratochvíl, DSc


Představení projektu
V současné době reprezentují pevné farmaceutické produkty (tablety a pilulky) asi 80-90% trhu s léčivy. Z toho plyne rostoucí význam kontroly procesu krystalizace ve farmaceutickém průmyslu. Vedle ekonomických motivů je distribuce a výroba aktivních farmaceutických ingrediencí (API) v požadované krystalové  modifikaci také striktním požadavkem všech významných autorit na trhu s léčivy (FDA, SÚKL). To vyplývá ze skutečnosti, že řada aktivních substancí vykazuje značný polymorfismus, což je schopnost molekuly existovat v několika různých krystalových formách. Již mnohokrát se ukázalo, že různé krystalové modifikace se mohou významně lišit svými farmakokinetickými vlastnostmi a tedy v konečném důsledku i terapeutickými účinky. Typickým příkladem tohoto chování je nedávný případ RITONAVIRu, což je léčivo s antivirálními účinky používané při napadení organismu virem HIV. Firma Abbott Laboratories tento lék uvedla na trh v roce 1996, avšak až po 18 měsících
modifikaci také striktním požadavkem všech významných autorit na trhu s léčivy (FDA, SÚKL). To vyplývá ze skutečnosti, že řada aktivních substancí vykazuje značný polymorfismus, což je schopnost molekuly existovat v několika různých krystalových formách. Již mnohokrát se ukázalo, že různé krystalové modifikace se mohou významně lišit svými farmakokinetickými vlastnostmi a tedy v konečném důsledku i terapeutickými účinky. Typickým příkladem tohoto chování je nedávný případ RITONAVIRu, což je léčivo s antivirálními účinky používané při napadení organismu virem HIV. Firma Abbott Laboratories tento lék uvedla na trh v roce 1996, avšak až po 18 měsících  bylo zjištěno, že v lékových formách vzniká nový termodynamicky stabilnější polymorf. Rozpustnost této nové formy byla v porovnání s originální modifikací pouze poloviční, a proto u pacientů nedošlo při předepsaném dávkování k dosažení terapeutické koncentrace léčiva v krevním oběhu. Pacienti tedy nebyli touto záměnou krystalových forem přímo poškozeni, ale také nebyli léčeni. A proto se problému polymorfismu věnuje náležitá pozornost a jsou vynakládány nemalé prostředky na to, aby při pochopení všech termodynamických a kinetických faktorů bylo možno bezpečně připravit a identifikovat požadovanou krystalovou modifikaci.
bylo zjištěno, že v lékových formách vzniká nový termodynamicky stabilnější polymorf. Rozpustnost této nové formy byla v porovnání s originální modifikací pouze poloviční, a proto u pacientů nedošlo při předepsaném dávkování k dosažení terapeutické koncentrace léčiva v krevním oběhu. Pacienti tedy nebyli touto záměnou krystalových forem přímo poškozeni, ale také nebyli léčeni. A proto se problému polymorfismu věnuje náležitá pozornost a jsou vynakládány nemalé prostředky na to, aby při pochopení všech termodynamických a kinetických faktorů bylo možno bezpečně připravit a identifikovat požadovanou krystalovou modifikaci.
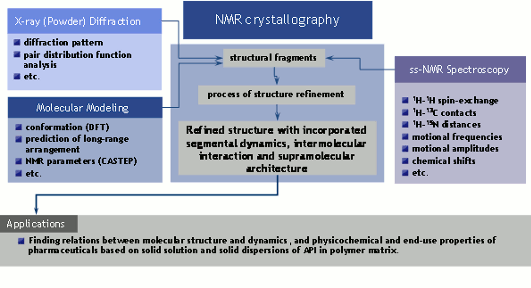
Strukturní vysvětlení polymorfismu, jakkoliv významného pro design léčiv, je však obvykle omezeno absencí efektivní analytické metody. V mnoha případech API neposkytují vhodné krystaly potřebné k získání úplných strukturních dat pomocí rtg difrakce. V současné době se však objevuje nová strukturně-analytická metoda souhrnně nazývaná “NMR krystalografie“, která je založena na kombinaci moderních technik NMR spektroskopie pevného stavu, práškové rtg difrakce a výpočetních a modelovacích postupů.
Účel projektu a jeho cíle
Účelem tohoto projektu je vypracování nových postupů
 analytických technik NMR krystalografie vedoucích k monitorování výroby farmakoproduktů, ke snadné a bezpečné identifikaci fázových nečistot a příměsí (polymorfů) a pro detailní popis krystalové struktury použitých farmaceuticky aktivních látek. Konečným cílem projektu je optimalizace těchto postupů pro charakterizaci nových léčiv na bázi nanokrystalických nebo částečně neuspořádaných až amorfních systémů, které jsou v současné době velmi intenzivně zkoumány. Zájem o tyto formy aktivních léčiv vyplývá z jejich snadné biodostupnosti v organismu. Vzhledem k současným vysokým nárokům, které jsou na kvalitu léčiv a jejich charakterizaci kladeny budou tyto metody cíleně navrženy pro průmyslové podmínky. Navržené metody tak budou poskytovat požadované informace v krátkém čase na základě minimalizovaného množství experimentálních dat, budou umožňovat predikci úplné krystalové struktury a zároveň povedou (doufáme) k vysvětlení jejich farmakokinetického chování a biodostupnosti v organismu.
analytických technik NMR krystalografie vedoucích k monitorování výroby farmakoproduktů, ke snadné a bezpečné identifikaci fázových nečistot a příměsí (polymorfů) a pro detailní popis krystalové struktury použitých farmaceuticky aktivních látek. Konečným cílem projektu je optimalizace těchto postupů pro charakterizaci nových léčiv na bázi nanokrystalických nebo částečně neuspořádaných až amorfních systémů, které jsou v současné době velmi intenzivně zkoumány. Zájem o tyto formy aktivních léčiv vyplývá z jejich snadné biodostupnosti v organismu. Vzhledem k současným vysokým nárokům, které jsou na kvalitu léčiv a jejich charakterizaci kladeny budou tyto metody cíleně navrženy pro průmyslové podmínky. Navržené metody tak budou poskytovat požadované informace v krátkém čase na základě minimalizovaného množství experimentálních dat, budou umožňovat predikci úplné krystalové struktury a zároveň povedou (doufáme) k vysvětlení jejich farmakokinetického chování a biodostupnosti v organismu.
Řešitelský tým
Pro řešení projektu byl sestaven rozsáhlý tým vysoce kvalifikovaných a zkušených odborníků (vědeckých pracovníků, studentů a techniků) z oblasti NMR spektroskopie a RTG krystalografie, jejichž domovskými institucemi jsou Ústav makromolekulární chemie AV ČR v.v.i. a Vysoká škola chemicko-technologická v Praze.
 ÚMCH AV ČR v.v.i.
ÚMCH AV ČR v.v.i. |
 VŠCHT Praha
VŠCHT Praha |
|
|
Postup prací - I. Etapa
I. Etapa - experimentální postupy NMR krystalografie pro krystalograficky jednoduché systémy
V první etapě projektu (rok 2008) byly rozpracovány postupy NMR spektroskopie pevného stavu, které umožnily strukturní charakterizaci relativně jednoduchých farmaceuticky aktivních látek (léčiv, API). V tomto bodě jsme se především zaměřili na rozpracování obecné koncepce NMR krystalografie ve smyslu účinné kombinace různých experimentálních a výpočetních postupů.
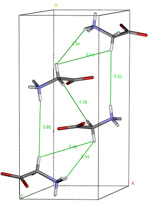
V detailu jsme pak vypracovali metody přesného měření 1H-13C dipolárních interakcí, přičemž zoptimalizované experimentální postupy dipolární NMR spektroskopie jsme aplikovali na popis fázové přeměny a struktury nových námi objevených krystalových forem simvastatinu. Bylo zjištěno, že simvastatin tvoří enantiotropní trimorfní systém (Obr. 2). První fáze krystalizuje za pokojové teploty, ta při teplotě kolem 261 K přechází na druhou fázi, a ta při teplotě 223 K na fázi třetí. Ačkoli originální krystalová forma je relativně jednoduchá a v nezávislé části krystalové buňky obsahuje pouze jednu molekulu, třetí krystalová modifikace obsahuje v nezávislé části krystalové buňky molekuly dvě. Tím se významně zkomplikoval zkoumaný systém a určení 3D struktury přešlo na kvalitativně vyšší úroveň. Přesto jsme optimalizací technik dipolární NMR spektroskopie dokázali rozlišit podstatné inter- a intra-molekulární kontakty. Do procesu optimalizace krystalové struktury jsme zahrnuli i vliv segmentového pohybu flexibilního esterového konce a popsali jsme rozdíly v segmentové dynamice všech krystalových forem. Z provedených relaxačních a rekaplovacích experimentů jsme získali detailní informace o korelačních frekvencích a amplitudách pohybů všech polymerních segmentů molekul simvastatinu. Zároveň jsme detailně popsali celý proces transformace. Ukázali jsme, že vysoko-amplitudové pohyby nejsou utlumeny ani snížením teploty pod 243 K, kdy dojde pouze ke změně konformace esterového konce. Zamrznutí tohoto pohybu, ke kterému dojde až při teplotách pod 223 K, však vede ke vzniku další krystalové modifikace. Vzhledem k výše uvedeným komplikacím bylo nutné pro získání požadovaných strukturních informací využít práškových rtg. záznamů (synchrotronových dat) a jejich upřesněním pak získat přesné informace o krystalové struktuře všech třech forem simvastatinu.
Obr 2 - 13C CP/MAS NMR spektra měřená při různých teplotách, záznam z diferenciální skenovaní kalorimetrie a upřesněné konfirmace tří polymorfů simvastatinu
Postup prací - II. Etapa
V druhé etapě řešení projektu jsme metodické postupy navržené v předchozím roce rozpracovali a aplikovali na krystalograficky složité systémy, které obsahují dvě a více molekul v nezávislé části krystalografické jednotky. Především jsme se věnovali dokončení experimentálního testování technik založených na 1H-13C a 1H-1H-13C přenosu polarizace a to s cílem optimalizovat podmínky pro co nejselektivnější určení intramolekulárních a intermolekulárních kontaktů. Smyslem této aktivity bylo vyvinout postupy, které na jedné straně umožní určit konformaci molekul API a na straně druhé i jejich vzájemnou orientaci ve větším fragmentu krystalové buňky či nadmolekulárního útvaru v amorfních systémech. Takto jsme provedli jsme optimalizace šesti 2D korelačních technik:
i) 1H-13C FSLG-CP-HETCOR s proměnlivou Hartmann-Hahnovou cross-polarizací (HHCP),
ii) 1H-13C FSLG-LGCP-HETCOR s proměnlivou Lee-Goldburgovou cross-polarizací (LGCP),
iii) 1H-13C FSLG-SL-HHCP-HETCOR s konstantní HHCP a předřazeným 1H spin-lockovacím polem (SL)
iv) 1H-13C FSLG-SD-HHCP-HETCOR s konstantní HHCP a předřazenou 1H spin-difuzní periodou (SD),
v) 1H-13C REDOR FSLG-LGCP-HETCOR s proměnlivou LGCP a předřazeným REDOR filtrem,
vi) 1H-13C REDOR FSLG-SL-HHCP-HETCOR s konstantní HHCP, REDOR filtrem a předřazeným SL
Primárním produktem farmaceutického průmyslu jsou práškovité aktivní substance. Z tohoto důvodu jsme se v roce 2009 snažili optimalizovat metodiku řešení struktury z RTG práškových dat pořízených na synchrotronu (např. ESRF Grenoble). V rámci tohoto projektu byla vyvinuta komplexní procedura pro stanovení struktury prášků zahrnující přípravu a testování vzorku před měřením na synchrotronu (stanovení optimální zrnitosti a vyloučení preferenční orientace na monokrystalovém difraktometru Xcalibur PX), implementace softwaru FoxGrid pro řešení struktury (rozdělení výpočtu na více CPU nebo více PC v počítačovém clusteru), vyhodnocení navržených strukturních modelů programem CrystalCMP a upřesnění finální struktury (software GSAS nebo použití molekulární mechaniky v systému Accelrys Material Studio). Vyvinutá procedura byla úspěšně testována na 11-ti vzorcích aktivních farmaceutických substancí, jejichž strukturu se podařilo úspěšně vyřešit
Postup prací - III. Etapa
III. Etapa - rozšíření technik NMR krystalografie na nanokrystalické, částečně uspořádané až amorfní systémy
Je to nejen obtížně předpověditelný polymorfismus, se kterým se potýká farmaceutický průmysl při vývoji a výrobě léčiv, je to i problém nízké biologické dostupnosti řady z nich. Bio-dostupnost aktivních látek, které se podle BCS klasifikačního systému řadí do skupiny II, je řízena jejich rozpustností v gastrointesticiálním traktu. Zvýšení jejich dostupnosti tak lze dosáhnout přeformulováním tradičních krystalových modifikací do forem amorfních nebo do podoby tuhých roztoků léčiv v polymerních matricích. Zvýšena biodostupnost je však doprovázena výrazným nárůstem strukturní složitosti vzniklého vícesložkového systému. Za těchto podmínek je pak využití standardních experimentálních postupů identifikace léčiva velmi omezené, a proto byly v souladu s harmonogramem dříve vypracované postupy NMR krystalografie rozšířeny na nanokrystalické, částečně uspořádané a amorfní systémy. Smyslem této etapy bylo vyvinout postupy, které umožní charakterizovat amorfní formy léčiv a to jak v čistém stavu tak i v pevných lékových formulacích. V této souvislosti byly dopracovány postupy využití faktorové analýzy 19F MAS NMR spekter. Byla ověřena nejen schopnost této metody jednoznačně identifikovat různé amorfní produkty (Obr. 4), ale též byla stanovena spolehlivost metody identifikovat směsi amorfních modifikací a to i při jeho velmi nízkých koncentracích daného léčiva. Definitivně tak bylo potvrzeno, že faktorová analýza spektrálních dat zahrnujících NMR, FTIR či XRPD spektra je velmi spolehlivý prostředek identifikace farmaceutických produktů.
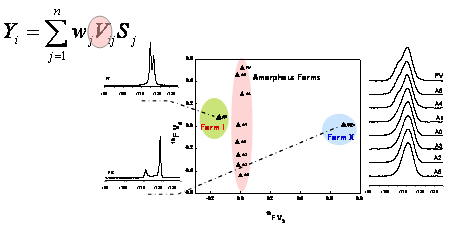
Komparativní faktorová analýza sad 19F MAS NMR, 13C CP/MAS NMR, FTIR a XRPD spekter (Obr. 5 vlevo) následně umožnila nalézt shodné spektrální prvky a rysy, které charakterizují strukturní variabilitu amorfních forem atorvastatinu. V odpovídajících subspekterch tyto spektrální parametry (signály) vykazují zvýšenou relativní amplitudu (Obr. 5 vpravo). Přiřazením těchto signálů odpovídajícím strukturním jednotkám, pak bylo možno identifikovat tu část molekuly, která je odpovědná za pozorovaný extrémní polymorfismus atorvastatinu a tak pochopit vznikající strukturní motivy ve velmi neuspořádaných až amorfních systémech.
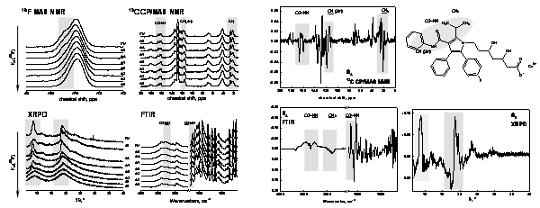
Přítomnost excipientu v tabletových formulacích či formulace léčiva do podoby tuhého roztoku v polymerní matrici nás vedla k hledání dalších postupů, které jsou alternativní vzhledem k tradičním experimentálním přístupům. Vedle výše zmiňované faktorové analýzy 19F MAS NMR spekter jsme se zaměřili na využití NMR spektroskopie kvadrupolových jader 11B a 23Na, která patří mezi nejcitlivější NMR-aktivní jádra vůbec. V této souvislosti jsme na modelových i aktivních látkách (např. karborán inhibující HIV proteázu) provedli rozsáhlé série 11B-11B(23Na) korelačních NMR experimentů. Získané výsledky poskytly nové strukturní informace i pro komplikované systémy léčivo-polymer (Obr. 6). To potvrzuje využitelnost těchto technik i ve farmaceutických laboratořích neboť implementace navržených postupů je relativně snadná.
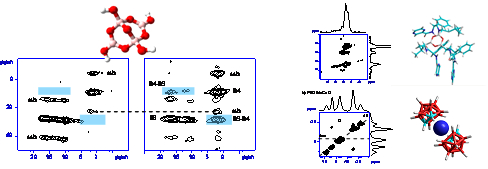
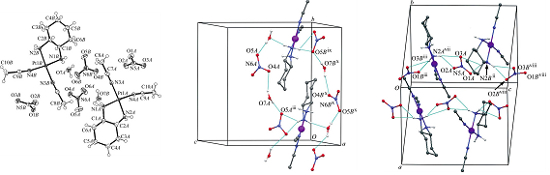
Součástí projektu je také strukturní charakterizace nově vyvíjených léčiv. Mimo jiné šlo o proti-rakovinové komplexy obsahujících platinu „cis-diacetonitrile [(1R,2R)-1,2-diaminocyclohexane-N,N‘] platinum(II) dinitrate mono-hydrát“ a „cis-[diiodo(1R,2R)-1,2-diaminocyclohexane-N,N‘] platinum(II)“, jež vykazují nižší toxicitu v porovnání s dnes používanými komplexy, a jejichž strukturu jsme v roce 2010 úspěšně vyřešily rentgenostrukturní analýzou (Obr. 7).
Postup prací - IV. Etapa
IV. Etapa - Minimalizace experimentálních dat, optimalizace metod pro průmyslové aplikace.
Bez ohledu na to, zda primární snahou výzkumníků je nalézt jednoznačné vztahy mezi strukturou látek a jejich fyzikálně-chemickými vlastnostmi, či zda je klíčovým úkolem zajistit vysokou kvalitu farmaceutických produktů a potravinových doplňků, možnost jejich výskytu v řadě různých krystalových forem a modifikací stále vyvolává potřebu vyvíjet metody jejich co nejpřesnější strukturní charakterizace. Přestože je tento problém předmětem badatelského zájmu již po několik desetiletí, představuje úplný strukturní popis mikro- a nanokrystalických látek (práškových produktů) stále jednu z velkých výzev moderní strukturní analýzy. Specifickou aplikační oblastí strukturní analýzy je farmaceutický výzkum a vývoj, který se při hledání a posléze i výrobě léčiv (aktivních farmaceutických ingrediencí – API) vážně potýká s problémem obtížně předpověditelného polymorfismu. Možnost dané aktivní látky vyskytovat se v několika krystalových modifikací může mít skrze rozpustnost dalekosáhlý vliv na bio-dostupnost a tedy i účinnost připraveného produktu. Je to však nejen obtížně předpověditelný polymorfismus, se kterým se farmaceutický průmysl potýká. Je to i problém nízké biologické dostupnosti řady nadějných léčiv, která jsou obtížně rozpustná v gastrointesticiálním traktu. Zvýšení jejich biologické dostupnosti lze mimo jiné dosáhnout přeformulováním tradičních termodynamicky stabilních krystalových modifikací do forem amorfních či částečně krystalických anebo lze komponovat tyto API do tuhých disperzí v polymerních matricích. Avšak těmito novými formulacemi výrazně narůstá strukturní složitost vzniklých vícesložkových systémů. Díky tomu je pro jejich strukturní charakterizaci nutno využít netradičních experimentální postupů, mezi které se v současné době řadí NMR krystalografie.
Podstatou řešeného projektu 2B08021 tak byla snaha učinit zásadní kroky při vývoji nových experimentálních postupů charakterizace práškových farmaceutických produktů. Základní koncept projektu byl založen na vývoji a následné aplikaci postupů NMR krystalografie, jež kombinují techniky NMR spektroskopie pevného stavu (ss-NMR), práškové rentgenové difrakce (XRPD) a molekulárního modelování (MM). Cílem projektu bylo vyvinutí metodických postupů, které i v podmínkách průmyslových laboratoří v krátkém čase a na základě minimalizovaného či mnohdy neúplného množství experimentálních dat povedou k identifikaci vzniklých produktů, predikci krystalové struktury a případně i k vysvětlení jejich farmakokinetického chování.
a. Rozvoj NMR krystalografie pro detailní strukturní popis farmaceutických systémůV celém průběhu řešení projektu jsme sledovali dva základní cíle. V první linii našeho výzkumu jsme se soustředili na rozvoj NMR krystalografie. Tento přístup, který byl poprvé rámcově formulován v roce 2005, je založen na sofistikovaném propojení i) práškové rtg. difrakce, ii) NMR spektroskopie pevného stavu a iii) počítačové predikce krystalové struktury spojené s kvantově chemickými výpočty NMR parametrů v periodických potenciálech. V prvních třech letech řešení projektu jsme se soustředili na optimalizaci jednotlivých experimentálních technik a postupů zpracování dat.
i) Experimentální techniky a postupy práškové rentgenové difrakce- Pokud jde o oblast práškové rentgenové difrakce tak se podařilo zoptimalizovat postupy měření a zpracování práškových difrakčních záznamů u systémů s preferenční orientací ve smyslu dosažení uspokojivého upřesnění krystalové struktury. Podařilo se též nalézt vztahy mezi morfologií farmaceutických krystalů s jejich vnitřní strukturou. Ukázalo se, že tato informace může pomoci při eliminaci vlivu preferenční orientace na výpočet struktury. Nalezený vztah lze také využít pro optimalizaci tvaru krystalů s ohledem na technologické požadavky při výrobě. V této souvislosti se podařilo najít základní korelace mezi nastavením predikčních parametrů software Accelrys Material Studio (modul Morphology) a skutečnými tvary krystalů.
- Dále se podařilo navrhnout a zoptimalizovat výpočetní proceduru (počítačový program) pro rychlou a spolehlivou klasifikaci krystalových struktur a jejich finální upřesnění „CrystalCMP“. Vyvinuli jsme tak komplexní proceduru pro stanovení struktury práškových produktů zahrnující přípravu a testování vzorku před měřením na synchrotronu (stanovení optimální zrnitosti a vyloučení preferenční orientace), implementaci softwaru FoxGrid pro řešení struktury, vyhodnocení navržených strukturních modelů programem CrystalCMP a upřesnění finální struktury.
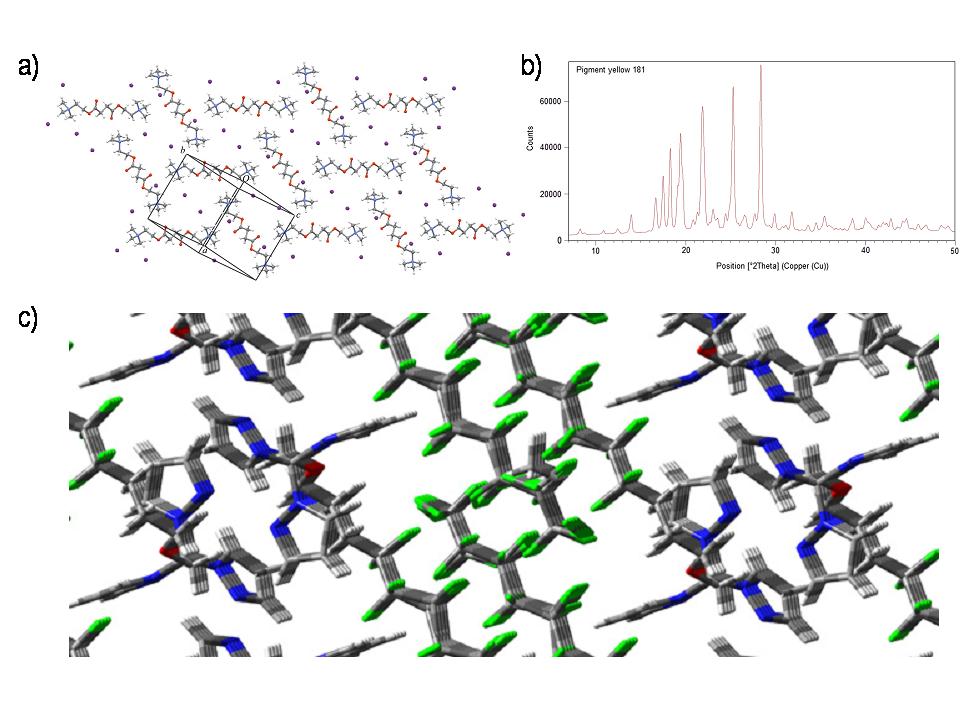
- Navrženými postupy jsme pak vyřešili krystalovou strukturu více jak dvaceti farmaceuticky relevantních strukturně komplikovaných látek (např. nízkoteplotní formy simvastatinu I-III, capecitabin, alaptide, metergoline I,II, methylisoalloxazine, cis-diacetonitrile [(1R,2R)-1,2-diaminocyclohexane-N,N‘] platinum(II) dinitrate mono-hydrát“ a „cis-[diiodo(1R,2R)-1,2-diaminocyclohexane-N,N‘] platinum(II) atd.) V této souvislosti byly v posledním roce řešení projektu upřesněna XRPD data a posléze navrženy struktury nové formy succinylcholine iodidu, beta-formy žlutého pigmentu 181, či objasněny strukturní vztahy polyfluoroalkylovaných tripyrazolylmethanoných ligandů (Obrázek 8).
ii) Experimentální techniky NMR spektroskopie pevného stavu
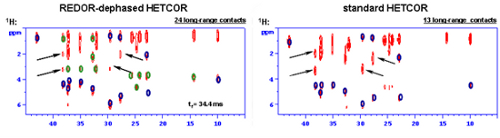
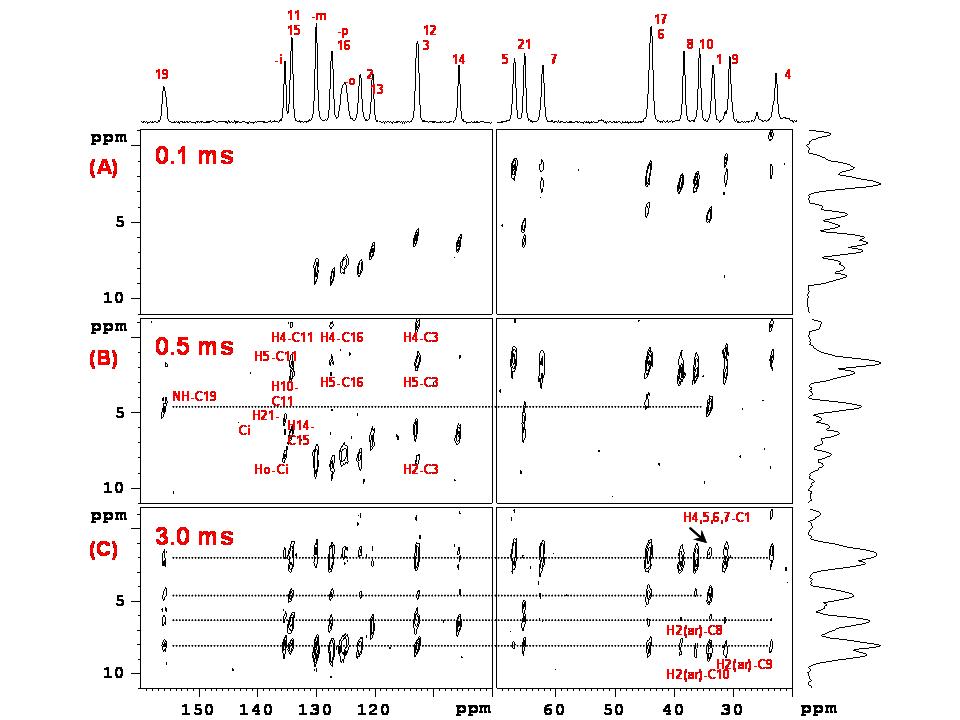
- V rámci rozvoje oblasti experimentálních technik NMR spektroskopie pevného stavu se během řešení projektu podařilo optimalizovat podmínky 1H-13C HETCOR NMR korelačních experimentů pro selektivní detekci intramolekulárních vodík-uhlíkových kontaktů pro určení konformace jednotlivých molekul. Během prvních 3 let řešení projektu jsme provedli celou řadu experimentů, kdy jsme na rozsáhlém souboru jednoduchých ale i velmi složitých systémů (alaptid, simvastatin I-III, metergolin I a II, taxol či perindopril erbumine, cobalt-bis-dikarbolid sodný) testovali různé postupy. Zjistili jsme, že nejvhodnější metodou je 1H-13C FSLG-LGCP-HETCOR experiment s proměnlivou Lee-Goldburgovou cross-polarizací, pomocí něhož jsou přednostně detekovány (relativně zesíleny) vodík-uhlíkové korelační signály s dosahem od 1 do 3.5 A. Druhým postupem je pak 1H-13C REDOR FSLG-LGCP-HETCOR korelačním experimentem s proměnlivou Lee-Goldburgovou cross-polarizací a předřazeným konstantním REDOR filtrem. Tímto postupem jsou selektivně detekovány (relativně zesíleny) vodík-uhlíkové korelační signály s dosahem od 2.5 do 4.5 A (přímé jednovazebné korelace jsou potlačeny). V posledním roce řešení projektu jsme prokázali, že ačkoli pro přesné měření meziatomové vzdálenosti je nutné naměřit sérii minimálně 20 korelačních spekter s proměnlivou LGCP periodou v intervalu 10-3500 mikrosekund, tak pro nalezení krátkých, středních a dlouhých meziatomových kontaktů stačí provést pouze tři experimenty s délkou směšovací periody nejlépe 100-400, 500-1000 a 3000-3500 mikrosekund (Obrázek 9). Tímto způsobem se sníží potřebný experimentální čas, přičemž získané informace lze již využít pro optimalizaci lokální struktury molekuly a následně pak využít jako vstupní model pro predikci krystalové struktury a výpočet NMR parametrů v periodickém potenciálu CASTEP NMR protokolu. Zjistili jsme však, že v případě dynamického disorderu, segmentového pohybu nějakého molekulárního fragmentu, je počet získaných korelačních dat podstatně snížen. Nicméně prokázali jsme, že právě kombinace ss-NMR, XRPD dat se strukturní predikcí a výpočtem NMR parametrů umožňuje tento problém eliminovat.
- Dále se podařilo zoptimalizovat experimentální podmínky 1H-13C FSLG HETCOR NMR korelačních technik pro selektivní detekci intermolekulárních vodík-uhlíkových kontaktů pro určení uspořádání molekul v krystalových buňkách. Celkem jsme testovali 6 různých postupů a to opět na celé škále systémů, jež obsahovaly v základní krystalové buňce jednu či dvě symetricky nezávislé molekuly. V případě polymorfní formy II metergolinu se jednalo o dosud největší systém, jež byl podle našich informací řešen přístupem NMR krystalografie. Daný systém je tvořen dvěmi symetricky nezávislými molekulami C25H29N3O2 s velikostí buňky 45x5x20 A. Zjistili jsme, že nejvhodnější metodou k posouzení intermolelkulárních kontaktů vhodných k určení vzájemné orientace molekul je 1H-13C FSLG-SL-HHCP-HETCOR experiment s konstantní Hartmann-Hahnovou cross-polarizací a předřazeným proměnlivým spin-lockovacím polem (1H). V tomto případě jsme využili faktu, že organické sloučeniny jsou tvořeny uhlíkovým skeletem, který je obklopen obálkou převážně z vodíkových atomů. Ty díky vysokému gyromagnetickému poměru mají schopnost pociťovat vliv jiných sousedních vodíkových atomů a to až na vzdálenost 5-6 A. Díky proměnlivému 1H spin-lockovacímu poli lze prodlužovat dosah proton-protonových dipolárních interakcí. Naproti tomu, díky velmi krátké HHCP (50 mikrosekund) je pak tato informace selektivně zakodována do uhlíkových atomů s přímo vázaným vodíkem (CH, CH2). Je-li však předřazen konstantní REDOR filtr, lze dosáhnut pomocí delší HHCP (200-400 mikrosekund) zakodování této informace do neprotonizovných uhlíkových atomů. Díky kombinaci obou technik, pak lze získat dostatečný počet informací pro upřesnění i relativně velkého strukturního fragmentu. V kombinaci s technikami měření intramolekulárních kontaktů lze vytvořit jakýsi strukturní model, který je dostatečně přesný, aby umožnil správnou predikci krystalové struktury v reálném čase (týdny). Rychleji to prozatím díky omezené kapacitě výpočetních zařízení nebylo možné.
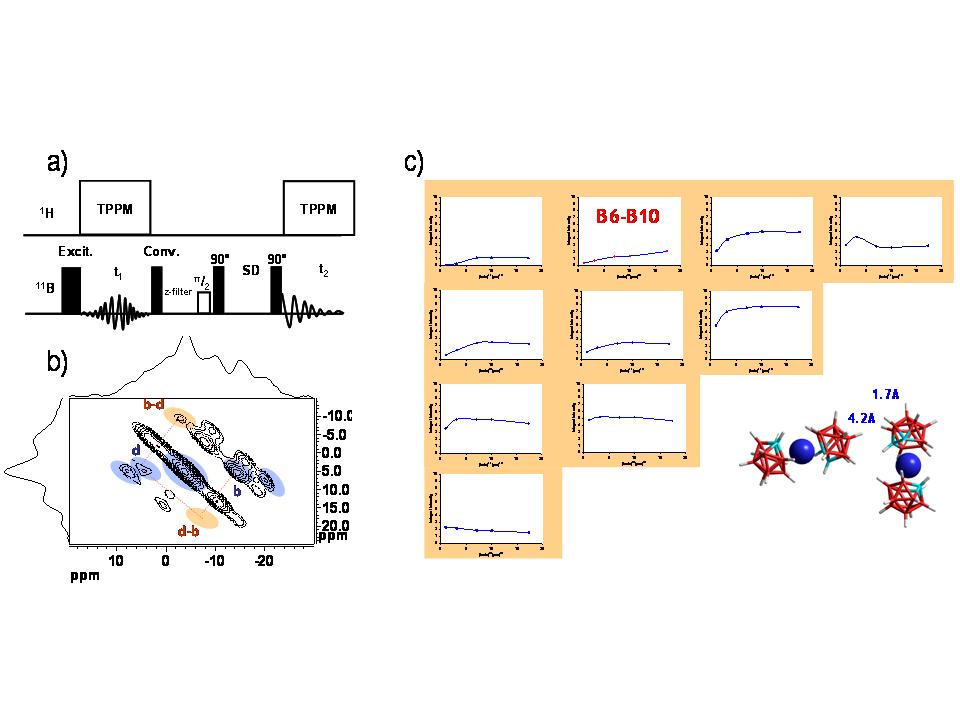
- V roce 2011 jsme také dokázali rozšířit tyto korelační HETCOR techniky na netradiční avšak citlivá jádra zahrnující kvadrupoly jako jsou 11B a 23Na (Obrázek 10), přičemž jsme vyřešili problém vyplývající z komplikované spinové dynamiky kvadrupolových jader a to užitím relativně slabých spin-lokovacích polí modulovaných frekvencí rotace.
- Zároveň jsme v roce 2011 potvrdili možnost využití 11B-11B korelačních experimentů pro posouzení orientace a vzájemné interakce karboránových klastrů. Pro tento účel jsme navrhli novou experimentální techniku kombinující vývoj tří-kvantových koherencí s 11B-11B spinovou difusí. Mimo jiné se ukázalo, že vhodné zpracování naměřených spekter například pomocí tzv. biaxiálního stříhání výrazně zvýší spektrální rozlišení (Obrázek 11). Za těchto podmínek pak bylo možné detailně monitorovat vývoj korelačních signálů a z odchylek od očekávaného vývoje zjistit vzájemnou orientaci karboránových klastrů.
iii) Kvantově chemické (DFT) výpočty a predikce krystalových struktur
- V prvních třech letech řešení projektu se nám podařilo nalézt vhodné výpočetní DFT postupy pro predikci struktury rozsáhlých molekulárních komplexů, jejichž vzájemné interakce jsou řízené slabými Van der Waalsovými (disperzními) silami.
- Posléze se nám podařilo implementovat výpočetní DFT postupy optimalizace a predikce struktur v periodických potenciálech programu Materials Studio modul CASTEP-NMR. V roce 2011 jsme pak provedli rozsáhlé studie v oblasti využití tohoto CASTEP-NMR modulu pro pochopení uspořádání molekul v krystalech a pro pochopení sil, které ovlivňují jejich finální molekulární geometrii. V této souvislosti jsme se soustředili na provádění výpočtů relativně komplikovaných struktur oligopeptidů Tyr-D-Ala-Phe, Tyr-Ala-Phe, které byly mimo jiné též provedeny pro účely kalibrace této metody, jež je nutná pro analýzu rozsáhlejších systémů. Tyto peptidické sekvence hrají klíčovou roli v aktivitě detrophinu I a II, jež jsou základní složkou některých toxinů. Náš zájem se soustředil především na posouzení role aminokyselinového zbytky D-Alaninu.
- V roce 2011 se nám též podařilo nalézt a určit meze spolehlivosti vypočítaných NMR parametrů například 1H, 13C či 11B chemických posunů, což je nutná znalost pro finální výběr správné krystalové struktury ze série vypočítaných či predikovaných výsledků. Na základě porovnání řady experimentálních a kvantově-chemicky vypočítaných dat se ukázalo, že střední kvadratická odchylka u hodnot 13C NMR chemických posunů by neměla být větší jak 1.5 ppm (Obrázek 12). To znamená, že pokud jsou rozdíly mezi hodnotami chemických posunů vypočítané pro predikovanou strukturu a experimentálními NMR daty větší jak 1.5 ppm, pak s velkou pravděpodobností je predikovaná struktura nesprávná. Pro spolehlivé potvrzení správné predikce tak shoda experimentu s výpočtem musí být například v případě 13C NMR chemických posunů menší než je výše uvedená hodnota 1.5 ppm.
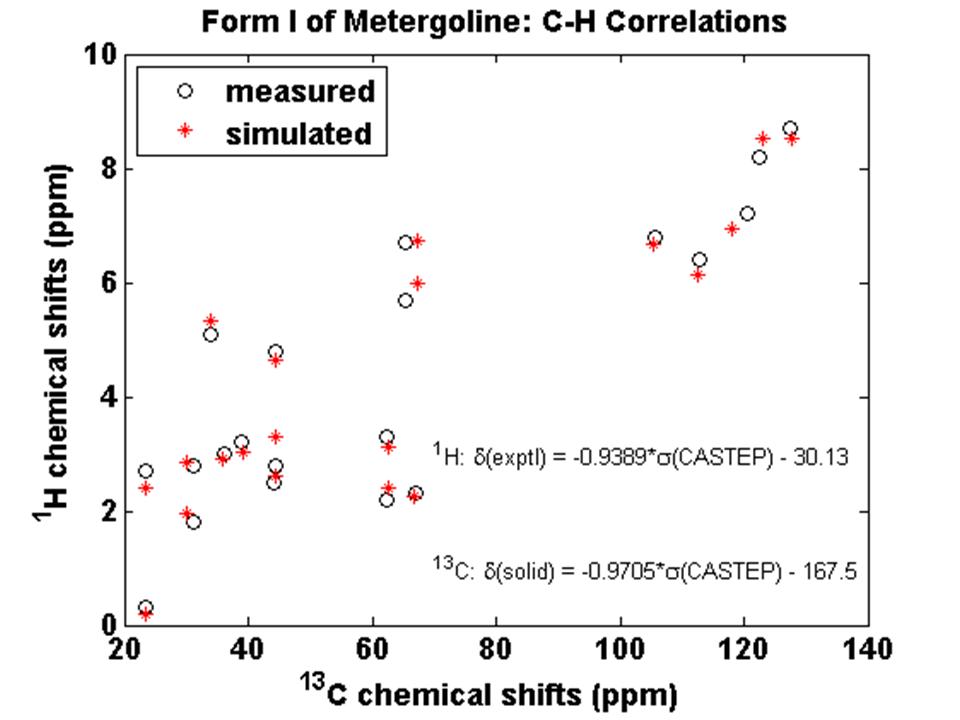
iv) Zobecnění a aplikace postupů NMR krystalografie
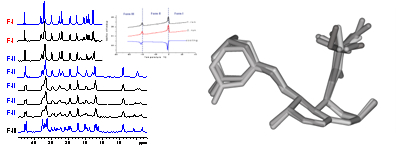
V roce 2011 jsme se však především pokoušeli dosažené dílčí výsledky a postupy vzájemně zkombinovat a propojit do jednoho komplexního protokolu, který by umožnil určit krystalovou strukturu i velmi rozsáhlých práškových krystalických systémů, pro které není možné získat kompletní spektroskopické informace. Toto omezení je velmi časté a plyne například z nedostatečného spektrálního rozlišení a z neúplného přiřazení NMR signálů. Další omezující faktor je dynamický disorder, tedy segmentový pohyb, který není primárně zahrnut do kvantově-chemických výpočtů ani do procedur optimalizace struktur z XRPD dat. V této souvislosti jsme v roce 2011 prokázali, že pomocí technik NMR spektroskopie pevného stavu lze zrekonstruovat základní strukturní fragmenty krystalických práškových materiálů. Tyto fragmenty pak lze skutečně využít jako referenční údaje pro upřesnění struktur z práškových difrakčních záznamů. Takto získané predikované struktury pak je možné analyzovat pomocí programu CASTEP-NMR a vypočítat hodnoty 1H a 13C chemických posunů. Tyto údaje pak porovnat s experimentálními daty. Na základě dobré či špatné shody experimentálních a vypočítaných dat pak lze vybrat správnou krystalovou strukturu, či modifikovat vstupní data (strukturní model) a celý proces opakovat. Tento postup jsme nejprve použili pro určení struktury metergolinu forma II. Tento systém tvořený dvěmi symetricky nezávislými molekulami C25H29N3O2 s velikostí buňky o objemu 4000 A3 představuje podle našich znalostí jeden z největších molekulárních systémů řešený přístupem NMR krystalografie. Z toho faktu však vyplynula řada omezení. Zaprvé, přestože jsme využili celou škálu experimentálních postupů včetně řady různých HETCOR a INADEQUTE experimentů, nepodařilo se nám úplně přiřadit všechny uhlíkové signály. Ne ve všech případech se podařilo zcela jednoznačně přiřadit signály symetricky nezávislým molekulám. Zcela přesně jsme spektroskopicky charakterizovali pouze střední část molekuly (Obrázek 13). Zadruhé jsme zjistili, že fenylový kruh podléhá rychlým 180° přeskokům. Tím byla snížena efektivita přenosu polarizace a bylo nutné při analýze 1H-13C korelačních spekter tento vliv kompenzovat.
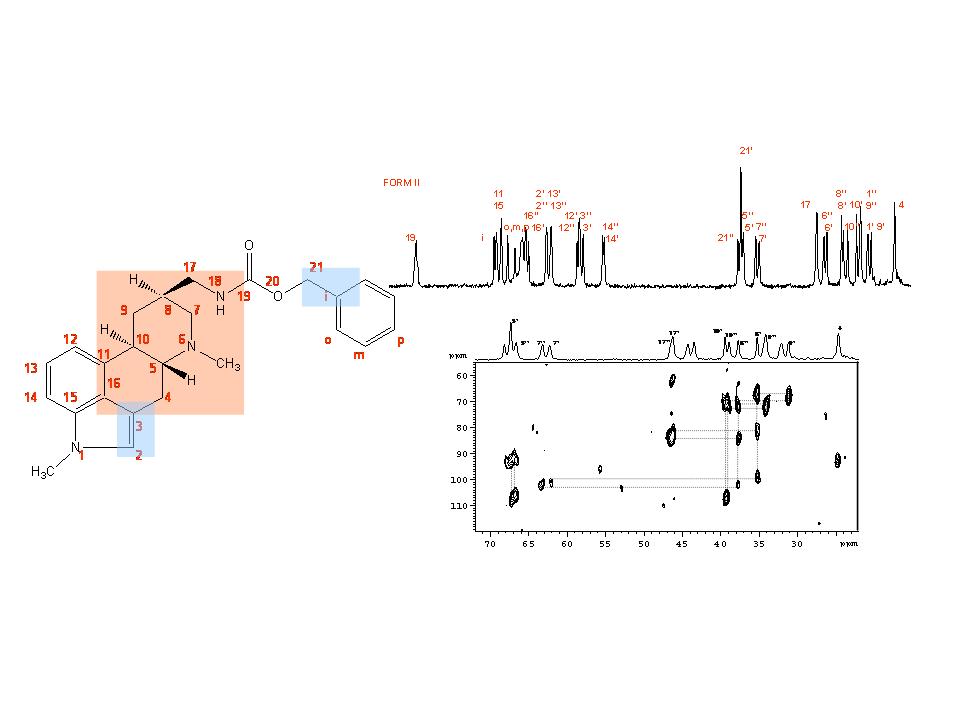
Nicméně i přes tato omezení se podařilo ze série 1H-13C HETCOR experimentů zrekonstruovat základní strukturní fragment a ten použít jako referenční údaj pro upřesnění struktury z XRPD dat. Tuto strukturu jsme pak využili pro výpočet NMR parametrů pomocí CASTEP-NMR modulu. Získané hodnoty pak byly porovnány s experimentálními daty. Vzhledem k tomu, že shoda obou sad hodnot NMR parametrů byla velmi dobrá, lze tvrdit, že jsme prokázali použitelnost tohoto postupu pro určování struktur i velmi složitých práškových materiálů, produktů farmaceutických výrob (Obrázek 14).
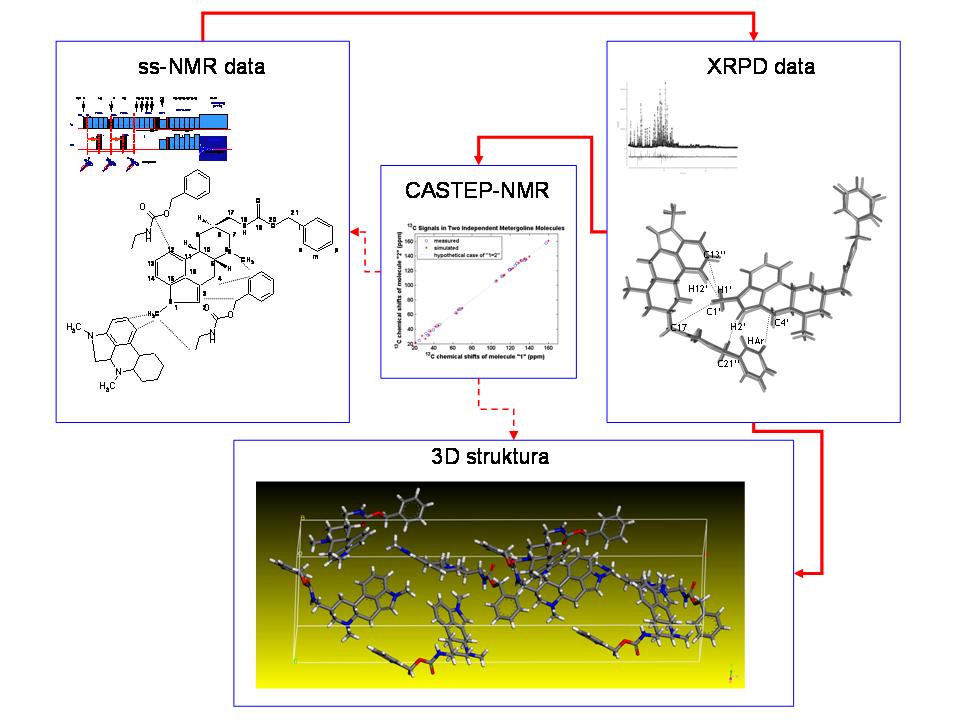
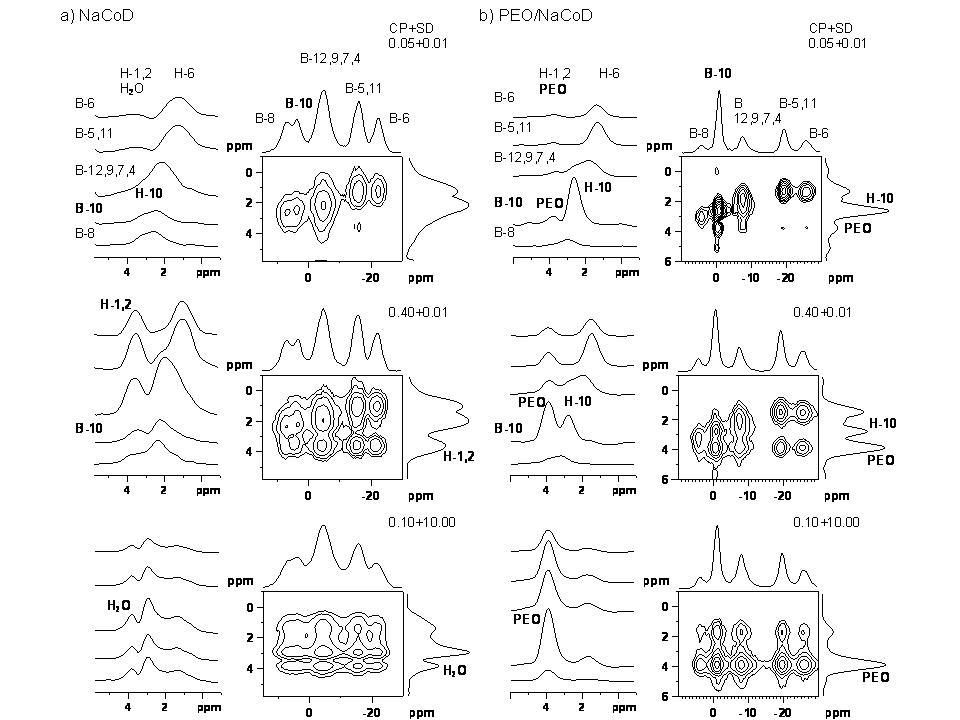
Ačkoli jsme náš výzkum v této linii řešení projektu primárně orientovali na detailní strukturní charakterizaci čistých aktivních substancí (léčiv, API), pokusili jsme se v posledním roce řešení projektu tento koncept rozšířit i na nové alternativní a především nadějné formulace málo rozpustných léčiv v podobě disperzí v polymerních matricích. V současné době se ukazuje, že tento typ formulace léčiv s nevhodným disolučním profilem je velmi výhodný. Dokonce i téměř nerozpustné substance mohou být tímto způsobem podstatně účinněji převedeny do roztoku v gastrointersticiálním ústrojí. Vhodným produktem na kterém jsme tuto metodiku zoptimalizovali a testovali byla tuhá polymerní disperze na bázi kobalt-bis-dikarbolidu sodného (NaCoD) v matrici polyethylen oxidu (PEO). Vedle mnoha jiných vlastností jsou tyto karboránové sloučeniny považovány za potenciální inhibitory HIV proteázy. Na druhou stranu tyto sloučeniny obvykle vykazují jen velmi malou rozpustnost, a proto převedení těchto látek do formy tuhé polymerní disperze má velký praktický význam. Na tomto konkrétním případu se ukázalo, že za pomoci 1H-13C HETCOR korelačních experimentů lze stanovit velikost domén PEO řetězců. Užitím 1H-23Na korelačních experimentů přesně lokalizovat pozici sodíkových iontů, a ze série 1H-11B HETCOR korelačních experimentů posoudit distribuci kobalt-bis-dikarbolidových klastrů v matrici a nalézt místa specifických interakcí. Pomocí 23Na a 11B MQ/MAS NMR spekter byl stanoven počet strukturně či krystalograficky neekvivalentních sodíkových iontů a CoD klastrů v systému. Z těchto údajů byl stejně jako v případě metergolinu II sestaven primární strukturní či referenční model. Získaná difrakční data (WAXS) byla dále analyzována Rietveldovou metodou a upřesněna do podoby finální 3D periodické struktury. Tato struktura byl konfrontována s referenčním modelem ve smyslu nalezení co nejlepší shody. Takto jsme testovali deset potenciálních struktur. Nakonec byla vybrána struktura, která v deseti případech vykazovala shodu mezi vypočítanými a experimentálně stanovenými difrakčním reflexemi (Obrázek 15).
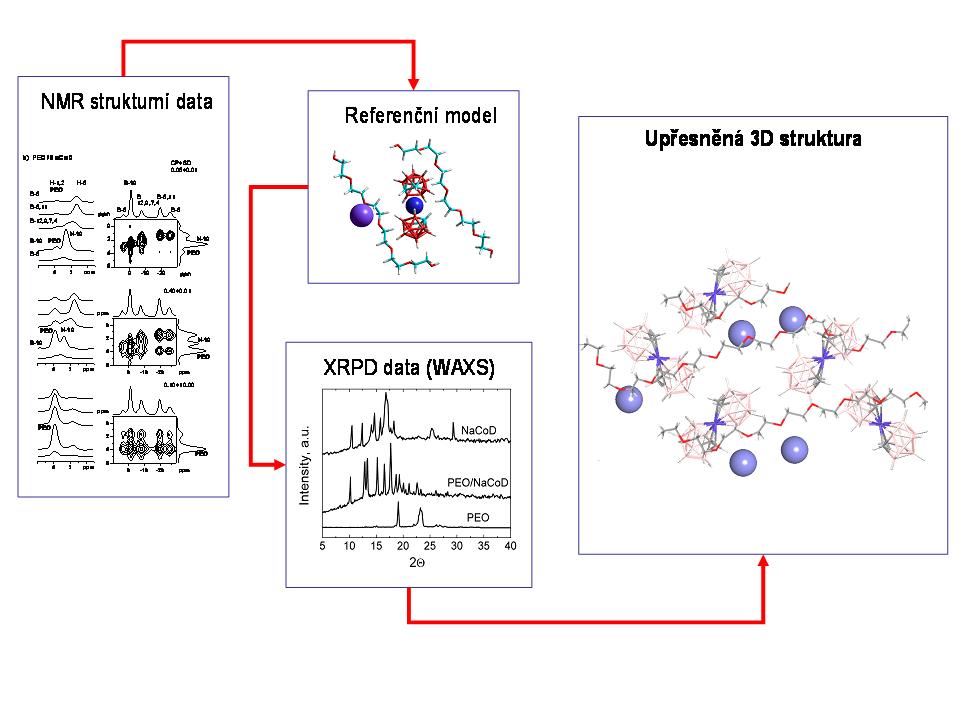
Výsledky tohoto výzkumu potvrzují, že námi navržený koncept NMR krystalografie představuje v jistém smyslu univerzálně využitelnou metodu charakterizace farmaceutických systémů. Je zřejmé, že princip NMR krystalografie se neomezuje jen na jednoznačně definované mikrokrystalické systémy (čisté farmaceutické substance), ale lze jej využít i na krystalograficky komplikované systémy s velkým objemem základní krystalové buňky, vykazující vnitřní segmentový pohyb. Je také zřejmé, že tento přístup lze zobecnit a využít pro strukturní charakterizaci více složkových systémů, jejímiž typickými představiteli jsou tuhé disperze léčiv v polymerních matricích.
2. Metody rychlé a spolehlivé charakterizace a identifikace farmaceutických produktůParalelně s výše uvedeným strukturním výzkumem jsme se v druhé linii řešení projektu pokoušeli vyvinout optimální postupy rychlé a spolehlivé identifikace farmaceutických produktů. Zvláště jsme se soustředili na amorfní a disorderované formy léčiv v jejich tabletových formulacích. Důvodem tohoto zájmu byl fakt, že amorfní formy vykazují lepší biologickou dostupnost (rozpustnost), a že tabletové formulace jsou skutečným finálním produktem farmaceutických výrob. Naší snahou bylo vyvinout postupy, které by byly přímo použitelné v průmyslových laboratořích, bez velkých nároků na přístrojové vybavení či experimentální čas. Náš zájem se tak koncentroval na charakterizaci amorfních forem aktivních substancí a jejich alternativních formulací v polymerních disperzí, neboť tyto nabízejí možnosti zvýšení biologické dostupnosti hydrofobních léčiv v porovnání s tradičními krystalickými formami. V tomto bodě našeho výzkumu jsme se primárně soustředili na interpretaci jednoduše detekovatelných spektroskopických dat, především 19F MAS NMR spekter. Ukázalo se totiž, že téměř 30% farmaceuticky aktivních látek obsahuje ve své molekule atom či atomy fluoru. Na druhou stranu atom fluoru se prakticky nikdy nevyskytuje v molekulách přídavných pomocných látek a excipientů.
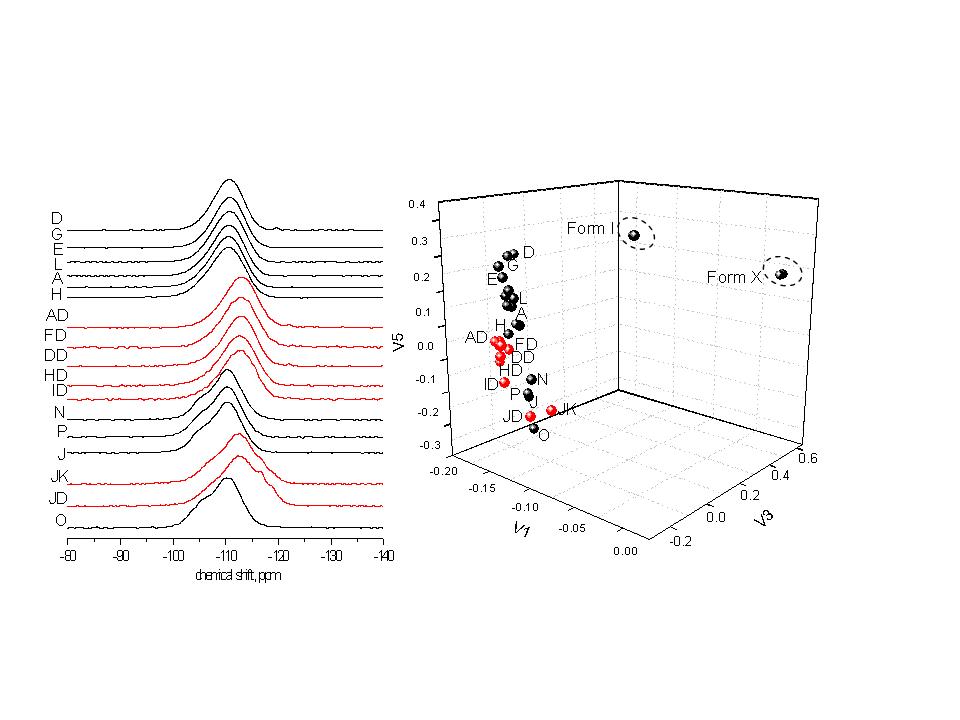
- V prvních třech letech řešení projektu se podařilo, poněkud překvapivě, nalézt jednoznačné korelace mezi XRPD, FTIR, 13C CP/MAS NMR a 19F MAS NMR experimentálními daty. Ukázalo se, že různé amorfní a disorderované formy atorvastatinu v čistém stavu lze se stejnou mírou správnosti a přesnosti (jednoznačnosti) identifikovat pomocí faktorové analýzy všech těchto experimentálních dat. Díky tomuto zjištění bylo možno využít výše uvedených korelací a optimalizovat chemometrickou metodu založenou na faktorové analýze 19F MAS NMR spekter pro jednoznačnou identifikaci amorfních a disorderovaných farmaceutických substancí v tabletových formulacích, tedy v systémech, kde obsah aktivní složky je menší jak 5%.
- V roce 2011 jsme se věnovali modifikaci výše uvedené metody pro jednoznačnou identifikaci aktivních substancí v tuhých polymerních disperzích. V těchto případech je problém značně komplikován tím, že zdánlivě inertní polymerní matrice může způsobovat, a my jsme prokázali, že skutečně způsobuje, podstatné změny ve vzhledu 19F MAS NMR spekter. Ukázalo se, že vliv polymerní matrice na spektroskopické charakteristiky 19F MAS NMR spekter aktivních substancí je dvojího druhu. V prvém případě nejsou pozorované změny v charakteru 19F MAS NMR spekter důsledkem změn ve struktuře molekul, ale důsledkem změn v dielektrických vlastnostech zkoumaného materiálu (vliv susceptibility). Ukázalo, že v určitých případech, například kdy je excipient nabit elektrostatickým nábojem nebo když jsou částice či domény API velmi malé, cca. pod 100 nm, pak se celý 19F MAS NMR signál nepředvídatelně posouvá na frekvenční NMR škále a to v obou směrech, přičemž největší zaznamenané změny dosahují až několika ppm (Obrázek 16). Z uvedeného obrázku je též zřejmé, že se mění štěpení signálů a jejich pološířka. Jednoduchá interpretace by mohla vést k závěru, že se jedná o nové krystalové modifikace, ale tak to není. Jednalo se vždy o jeden a tem samý polymorf.
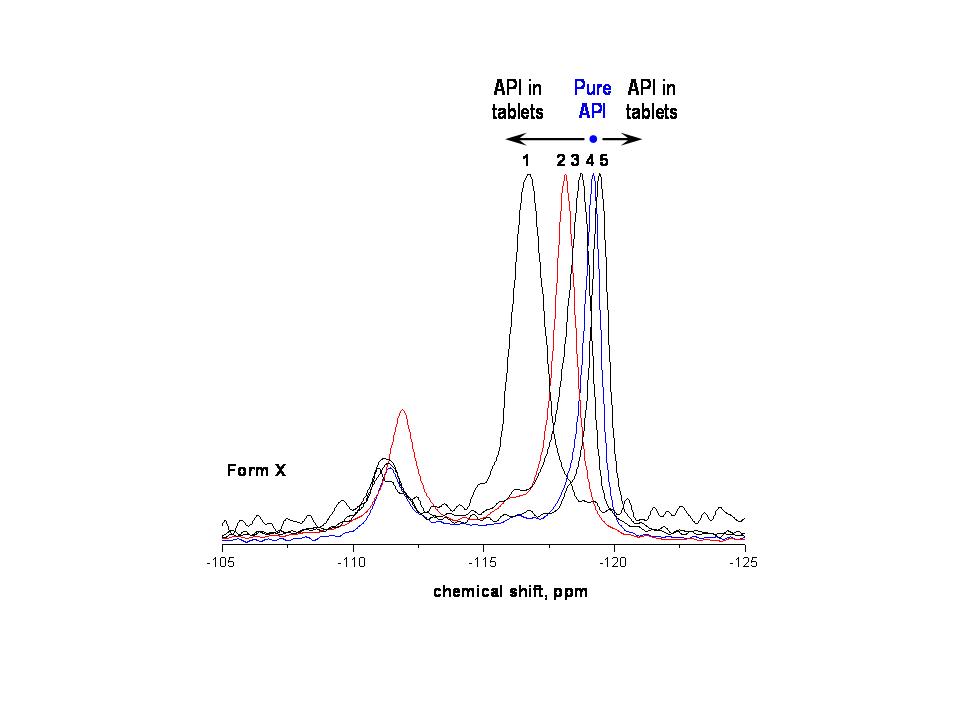
Na druhou stranu jsme ale také zaznamenali změny ve vzhledu 19F MAS NMR spekter, které skutečně odrážejí strukturní změny v konformaci a uspořádání molekul aktivní substance, jež jsou indukované polymerní matricí. Například se může jednat o vznik nových krystalových forem v relativně izolovaných doménách API či o vznik molekulárních komplexů API-polymer, kde molekuly léčiva jsou přímo zabudovány či fyzikálně interagují s molekulami polymeru. Je tedy zřejmé, že triviální vizuální interpretace 19F MAS NMR spekter může být velmi komplikovaná. Nicméně se prokázalo, že použitím faktorové analýzy je možné systematický nestrukturní vliv excipientu na 19F MAS NMR spektra eliminovat a tak přímo posuzovat strukturní změny molekul léčiva (Obrázek 17). V roce 2011 se tak podařilo prokázat, že faktorová analýza 19F MAS NMR spekter je účinná procedura rychlé a spolehlivé identifikace farmaceutických substancí v nejrůznějších formulacích.
Nedílnou součástí řešení projektu byla naše snaha získané informace co nejrychleji a nejúčinněji převádět k pracovníkům oddělení výzkumu a vývoje farmaceutických společností, případně k pracovníkům úřadů, jež jsou základní autoritou na trhu léčiv (Státní ústav pro kontrolu léčiv). K tomuto účelu jsme organizovali semináře a vzdělávací kursy. V letech 2008-2011 jsme uspořádali 5 workshopů (např. 5. workshop NMR pevného stavu a souvisejících výpočtových metod, který se v budově ÚMCH uskutečnil 6.12.2011), a vzdělávacích kursů a referovali na řadě konferencí. Příkladem může být zvaná přednáška na specializovaném 13th International Worskhop on Physical Characterization of Pharmaceutical Solids, který byl roce 2011 organizován ve USA, Indianapolis. Podstatné výsledky jsme shrnuli do více jak 20 vědeckých publikacích, přičemž o nekolizních výsledcích jsme průběžně poskytovali informace na webových stránkách projektu, kde je též uveden seznam všech publikačních výstupů.
Za celou dobu řešení projektu v letech 2008-2011 dosaženo 70 publikačních výstupů (v roce 2011 bylo v RIV nalezeno 14 záznamů)
18 článků v odborných časopisech – vyšlé2 články zaslané do redakce k recenznímu řízení – přijaté k tisku
2 články zaslané do redakce k recenznímu řízení
2 články připravované
1 kapitola v knize
2 články ve sbornících
16 přednášek na konferencích (tři zvané)
23 posterů na konferencích
5 workshopů a seminářů
1 software
výsledky a výstupy
Abstrakta, prezentace nebo celé texty volně ke stažení (formát pdf, jpg).
Vyberte období 2008,
2009,
2010,
2011 I,
2011 II
webová prezentace
